COVID-19 – Targetkan Omicron, AS setujui vaksin ‘booster’ Pfizer dan Moderna yang diperbarui
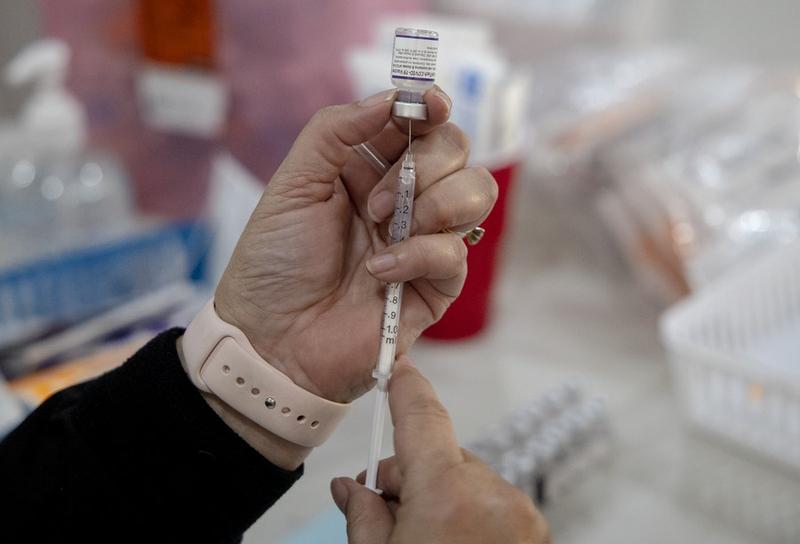
Seorang tenaga kesehatan menyiapkan satu dosis vaksin COVID-19 di sebuah klinik vaksin di San Antonio, Texas, Amerika Serikat, pada 9 Januari 2022. (Xinhua/Nick Wagner)
Vaksin booster Moderna dan Pfizer-BioNTech telah disetujui oleh Badan Pengawas Obat dan Makanan AS untuk melawan subvarian Omicron BA.4 dan BA.5 yang sekarang ini menjadi penyebab mayoritas kasus COVID-19 di negara tersebut.
Los Angeles, AS (Xinhua) – Badan Pengawas Obat dan Makanan (Food and Drug Administration/FDA) Amerika serikat (AS) pada Rabu (31/8) menyetujui suntikan penguat (booster) vaksin COVID-19 yang diperbarui buatan Moderna dan Pfizer-BioNTech yang menargetkan subvarian Omicron.Suntikan booster yang diperbarui tersebut mengandung dua komponen mRNA dari virus SARS-CoV-2, yakni satu komponen dari galur pertama SARS-CoV-2 dan satu komponen lainnya merupakan komponen yang umum ditemukan di antara subvarian BA.4 dan BA.5 dari varian Omicron SARS-CoV-2, menurut FDA.Subvarian Omicron BA.4 dan BA.5 sekarang ini menjadi penyebab mayoritas kasus COVID-19 di AS, dan diperkirakan akan menyebar pada musim gugur dan musim dingin tahun ini, menurut Pusat Pengendalian dan Pencegahan Penyakit (Centers for Disease Control and Prevention/CDC) AS.Suntikan booster Moderna yang diperbarui mendapat izin penggunaan sebagai dosis booster tunggal pada individu berusia 18 tahun ke atas. Sementara itu, dosis booster Pfizer-BioNTech disetujui untuk digunakan sebagai dosis booster tunggal pada individu berusia 12 tahun ke atas, menurut FDA.
Foto yang diabadikan pada 23 Agustus 2021 ini menunjukkan gedung Badan Pengawas Obat dan Makanan (FDA) Amerika Serikat (AS) di Silver Spring, Maryland, Amerika Serikat. (Xinhua/Ting Shen)
Bagikan
Komentar
Berita Terkait

COVID-19 – WHO pastikan vaksin tersedia bagi seluruh negara di dunia
Indonesia
•
26 Aug 2020

Penelitian di Australia ungkap peningkatan drastis dalam penggunaan medsos di kalangan anak-anak
Indonesia
•
20 Nov 2025

Kasus bunuh diri anak di Jepang catat rekor tertinggi pada 2025
Indonesia
•
30 Jan 2026
Sinop di wilayah Laut Hitam jadi kota paling bahagia di Turkiye
Indonesia
•
20 Aug 2024
Berita Terbaru

Feature – Lansia di China nikmati masa pensiun dengan jadi ‘content creator’
Indonesia
•
05 Feb 2026

Perlintasan Rafah kembali dibuka, PBB harapkan lebih banyak negara terima pasien dari Gaza
Indonesia
•
03 Feb 2026

Mesir mulai terima pasien dan korban luka dari Gaza via perlintasan Rafah
Indonesia
•
03 Feb 2026

Feature – Menyusuri jejak masa lalu di Pecinan Glodok, dari klenteng, gereja, hingga tradisi teh China
Indonesia
•
02 Feb 2026
